Η ΕΛΑΙΟΚΑΝΘΑΛΗ ΑΠΟΤΕΛΕΙ ΠΙΘΑΝΗ ΜΕΛΛΟΝΤΙΚΗ ΘΕΡΑΠΕΙΑ ΤΗΣ ΝΟΣΟΥ ALZHEIMER
Η ελαιοκανθάλη, μια φυσική πολυφαινόλη που βρίσκεται στο πολυφαινολικό ελαιόλαδο, φαίνεται πως μπορεί να παίξει σημαντικό ρόλο στην αντιμετώπιση της νόσου Alzheimer (AD).
Στη νόσο αυτή, η πρωτεΐνη Τ συσσωρεύεται και σχηματίζει νευροϊνιδιακά πλέγματα, τα οποία συμβάλλουν στη νευροεκφύλιση και στη μνήμης απώλεια. Η μελέτη έδειξε ότι η ελαιοκανθάλη μπορεί να αναστείλει τον σχηματισμό ινιδίων της πρωτεΐνης Τ, «κλειδώνοντάς» την στη φυσιολογική της μορφή και εμποδίζοντας την παθολογική της αλλοίωση.
Ο μηχανισμός δράσης βασίζεται στις δύο αλδεϋδικές ομάδες της ελαιοκανθάλης, οι οποίες συνδέονται με συγκεκριμένα σημεία της πρωτεΐνης (π.χ. με την αμινομάδα της λυσίνης), εμποδίζοντας έτσι τη δημιουργία παθολογικών ινιδίων. Σημαντικό είναι ότι αυτή η δράση δεν επηρεάζει την ομαλή λειτουργία της πρωτεΐνης Τ.
Τα ευρήματα αυτά δείχνουν ότι η ελαιοκανθάλη δεν είναι απλώς ένα πολύτιμο συστατικό της διατροφής μας, αλλά ενδέχεται να αποτελέσει τη βάση για την ανάπτυξη νέων θεραπειών κατά των νευροεκφυλιστικών ασθενειών, όπως το Alzheimer.
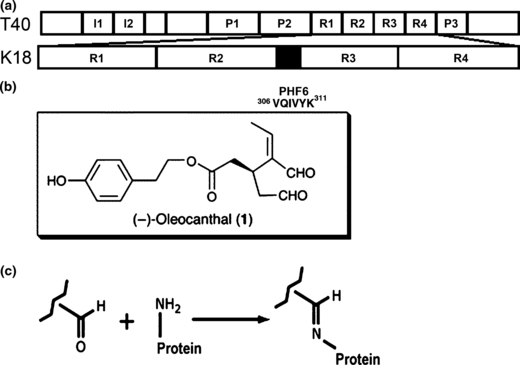
Figure: Human tau constructs, structure of oleocanthal and Schiff base reaction between oleocanthal and lysine side chain. Li et al., J. Neurochem. 2009
